 Catalyzer Moscow-1996
Catalyzer Moscow-1996
Определение числа Авогадро по радиоактивному распаду.
В 1908 г. Э.Резерфорд и Г.Гейгер измеряли скорость (x) испускания a-частиц радием (в природе этот элемент представлен единственным нуклидом 226Ra) и определили, что 1.00 г радия испускает x = 3.42×1010 a-частиц в секунду.
В 1911 г. Резерфорд и американский физикохимик Б.Болтвуд измерили скорость образования гелия из радия. Этот эксперимент позволил определить наиболее точное значение числа Авогадро для того времени (молярный объем идеальных газов был известен с хорошей точностью). В эксперименте навеску соли радия, содержащую m = 192 мг Ra и очищенную от продуктов распада, поместили в сосуд и измерили объем выделившегося гелия.
Через 83 суток (t = 83.0 сут) было собрано 6.58 мм3 He (VHe = 6.58 мм3 в пересчете на 0 oC и 1 атм). Для объяснения результатов эксперимента рассмотрим кинетическую схему радиоактивного распада Ra (над стрелками приведены периоды полураспада, под стрелками – тип распада):
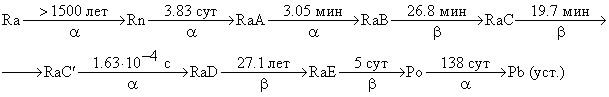
(RaA-RaE – промежуточные продукты распада).
1. Запишите уравнения первых шести реакций распада с указанием современных обозначений, атомных номеров и массовых чисел всех нуклидов.
В первом приближении можно считать, что периоды полураспада всех промежуточных продуктов распада, кроме RaD и Po, пренебрежимо малы по сравнению с временем эксперимента, t. Используя это приближение, выполните следующие расчеты:
2. а) Сколько атомов гелия образуется из каждого распавшегося атома радия за 83 суток?
б) Сколько атомов гелия всего образовалось за время эксперимента?
3. Используя полученные данные, рассчитайте приближенное значение числа Авогадро.
При более точном расчете числа Авогадро необходимо учесть, что период полураспада радона T1/2(Rn) = 3.83 сут сравним с временем эксперимента t и к концу эксперимента не все атомы радона распадаются.
4. Укажите, какой из приведенных ниже графиков описывает зависимость от времени числа атомов радона NRn в течение эксперимента.
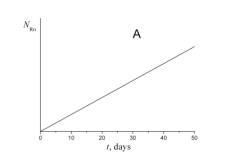
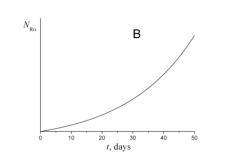
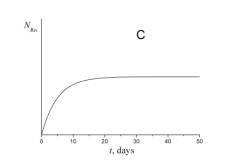
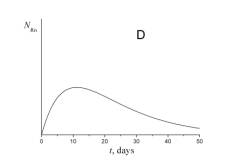
5. Укажите, какой из приведенных ниже графиков описывает зависимость от времени объема гелия VHe в течение эксперимента.
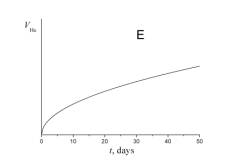
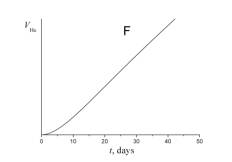
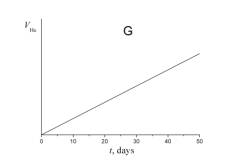
6. а) Используя сокращенную кинетическую схему
![]()
и график, который вы выбрали в вопросе 4, выведите соотношение между числом атомов радона в конце эксперимента N¢Rn и числом атомов радия NRa.
b) Оцените N¢Rn через приведенную выше скорость радиоактивного распада (x = 3.42×1010 a-частиц на грамм радия в секунду).
7. Сколько атомов гелия могли бы образоваться из атомов радона, оставшихся к концу эксперимента, N¢Rn, если бы все атомы радона распались до RaD?
8. Используя полученные вами результаты, рассчитайте более точное значение: а) числа образовавшихся атомов гелия; б) числа Авогадро.
 Решение
Решение
______________________________________________________________________
 Химические равновесия в растворах.
Химические равновесия в растворах.
Дихромат калия - один из наиболее широко применяемых осадителей. Следующие равновесия устанавливаются в водном растворе Cr(VI). ______________________________________________________________________ Стереохимию органических соединений можно иногда определить путем изучения их химического поведения. Стереохимическая конфигурация одного из изомеров 5-нонборнен-2,3-дикарбоновой кислоты (соединение Х) (стереохимическая конфигурация не показана) была изучена с помощью следующих экспериментов. При нагревании данное вещество разлагается с образованием воды и нового соединения Y. Соединение Y медленно растворяется в избытке водного раствора NaOH с образованием продукта Х1, аналогичного тому, что образуется в реакции Х с NaOH. Полученный раствор Х1 обработали I2 с образованием веществ, содержащих иод. Окисление раствора привело к образованию смеси двух изомерных соединений А и В в соотношении 3:1. Титрование 0.3913 г соединения А 0.1000 М водным раствором NaOH в присутствии фенолфталеина дало 12.70 мл щелочи. Такое же количество 0.1000 М водного раствора NaOH необходимо для титрования 0.3913 г соединения В. При нагревании соединение А медленно превращается в соединение С, которое не содержит иода и способно вступать в реакцию с водой. Соединение В в этих же условиях не реагирует, однако при нагревании с соляной кислотой медленно превращается в А. Все реакции должны быть написаны в виде уравнений. Механизмы не требуются. 1. Отметьте звездочкой (*) асимметрические атомы углерода в структурах 5-нонборнен-2,3-дикарбоновых кислот. 2. Нарисуйте стереохимические формулы всех стереоизоиеров соединения Х и структуры продуктов их дегидратации в тех случаях, где это возможно. 3. Напишите уравнения реакций NaOH со стереоизомерами Х и Y. 4. Рассчитайте молярную массу соединения А. Напишите уравнение реакции превращения Х1 в А. 5. Напишите уравнение реакции образования вещества С из А и реакции С с водой. 6. Изобразите стереохимическую формулу соединения Х, которая удовлетворяет всем условиям задачи. 7. Напишите уравнения реакций превращения В в А. 8. Являются ли соединения А и В диастереомерами?
HCrO4- + H2O = CrO42- + H3O+ pK1 = 6.50
2HCrO4- = Cr2O72- + H2O pK2 = -1.36
Все остальные равновесия с участием хрома не должны рассматриваться. Принять все коэффициенты активности равными 1.
1. Ионное произведение воды Kw = 1.0•10-14. Оцените константы равновесия
a) CrO42- + H2O = HCrO4- + OH-
b) Cr2O72- + 2OH- = 2CrO42- + H2O
2. Произведение растворимости BaCrO4 Ks = 1.2•10-10. BaCr2O7 хорошо растворим в воде. В каком направлении сместится равновесие 1b при добавлении следующих реагентов к умеренно концентрированному водному раствору дихромата калия?
a) KOH
b) HCl
c) BaCl2
d) H2O (принять во внимание все приведенные выше равновесия).
3. Константа диссоциации уксусной кислоты Ka = 1.8•10-5. Посчитайте значение pH следующих растворов
a) 0.010 M K2CrO4
b) 0.010 M K2Cr2O7
c) 0.010 M K2Cr2O7 + 0.10 M CH3COOH
4. Рассчитайте равновесные концентрации следующих ионов
в растворе 0.010 М K2Cr2O7 + 0.10 М CH3COOH
a) CrO42-
b) Cr2O72-
![]() Решение
Решение
![]() Определение стереохимии органических соединений по их химическому поведению.
Определение стереохимии органических соединений по их химическому поведению.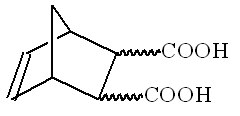
![]() Решение
Решение





